Pitot tube
Pitot tube (อ่านว่า: พิโต ทูป) คืออุปกรณ์ที่ใช้สำหรับวัดความเร็วลม ซึ่งถูกคิดค้นขึ้นมาโดยวิศวกรชาวฝรั่งเศส Henri Pitot (อองรี พิโต)ในต้นศตวรรษที่ 18 และได้รับการปรับเปลี่ยนเพื่อให้รูปแบบทันสมัยขึ้นในกลางศตวรรษที่ 19 โดย Henry Darcy วิศวกรชาวฝรั่งเศส

Pitot tube ใช้งานอย่างไร
จริงๆแล้ว Pitot tube เป็นเพียงท่อโลหะธรรมดาๆ ไม่สามารถหาหรือวัดความเร็วลมได้ด้วยตัวมันเอง การที่จะวัดความเร็วลมด้วย Pitot tube นั้น จะต้องใช้ร่วมกับ Manometer หรือ Differential pressure meter หรือเรียกเป็นภาษาไทยว่า เครื่องวัดความดันแตกต่าง โดยวิธีใช้คือเราจะนำปลายของ Pitot tube หันเข้าปะทะกับแรงลมและอีกด้านของ Pitot tube นั้นจะต่อสายยางกับเครื่องวัดความดันแตกต่าง เพื่อหาค่าความดันที่เกิดขึ้นและคำนวนเป็นความเร็วลมอีกที
Pitot tube ชนิดต่างๆ
โดยทั่วไปแล้ว Pitot tube จะมีหลักๆอยู่ 2 ชนิดคือ L และ S ซึ่งชนิด L จะมีให้เห็นอยู่มากกว่า เนื่องจากทำขึ้นได้ง่ายและราคาถูกกว่า จึงเป็นที่นิยม แต่ทั้ง 2 ชนิดนั้นก็มีการใช้งานในลักษณะที่แตกต่างกันซึ่งผู้ใช้หลายๆท่านอาจยังไม่ทราบถึงจุดนี้
Pitot tube type L
เหมาะสำหรับวัดลมในท่อ ซึ่งมาพร้อมกับตัวยึดแบบเลื่อนได้ (sliding) ที่ใช้สำหรับยึดกับท่อลมเวลาติดตั้ง
Pitot tube type S
เหมาะสำหรับวัดลมที่ปากท่อ เนื่องจากมีส่วนโค้งที่สั้น ทำให้สามารถวัดลมดูดที่ปากท่อได้
Pitot tube ทำงานอย่างไร
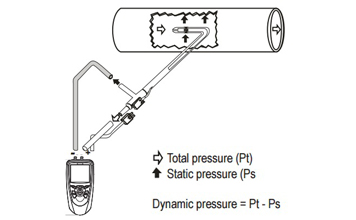
จากภาพตัวอย่างเมื่อเรานำปลายของ Pitot tube เข้าปะทะกับแรงลมแล้ว จะเห็นได้ว่ามีความดันจากลมเข้าไปใน Pitot tube ทั้งหมด 2 ชนิดคือ
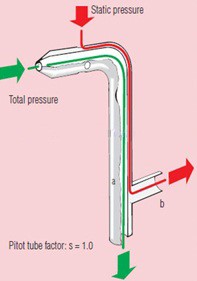
ความดันทั้งหมด (Total pressure)
เป็นความดันที่รับจากรูด้านหน้าของ Pitot tube ซึ่งเจ้า Total pressure ก็เหมือนกับชื่อที่เรียกละครับ มันคือความดันทั้งหมดที่เกิดขึ้นในระบบไม่ว่าจะเป็นความดันจากการเคลื่อนที่ของลมหรือความดันคงที่ที่เกิดจากความดันบรรยากาศจะเข้ามาในรูนี้ทั้งหมดครับ
ความดันคงที่ (Static pressure)
เป็นความดันที่รับจากรูรอบๆด้านข้างของ Pitot tube ซึ่งเจ้า Static pressure ก็เหมือนกับชื่อที่เรียกมันอีกนั้นละครับ มันคือความดันคงที่ที่เกิดจากความดันบรรยากาศในพื้นที่นั้นๆซึ่งมันมีอยู่แล้ว และแต่ละที่จะไม่เท่ากันครับ
จริงๆแล้วสิ่งที่เราจะหาคือสิ่งที่เรียกว่า ความดันไดนามิก (Dynamic pressure) มันคือความดันที่เกิดจากการเคลื่อนที่ของลมล้วนๆ ซึ่งเราสามารถหาได้โดยนำ
Total pressure - Static pressure = Dynamic pressure
นี่คือสาเหตุที่ทำไมเราต้องใช้ Pitot tube ร่วมกับเครื่องวัดความดันแตกต่าง ก็เพื่อที่จะหาค่าความแตกต่างระหว่าง Total pressure กับ Static pressure เพื่อนำไปสู่ผลลัพธ์คือ Dynamic pressure และนำค่า Dynamic pressure ที่ได้นั้นไปคำนวณเพื่อหาค่าความเร็วลมอีกที
คำนวณหาความเร็วลมจาก Pitot tube อย่างไร
จากที่อธิบายเบื้องต้นทำให้เราทราบว่า Dynamic pressure = Total pressure - Static pressure
จาก Bernoulli’s equation ทำให้เราทราบว่า..................................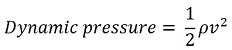
และเราสามารถเขียนสมการขึ้นมาใหม่ในรูปของ ความเร็วลม ได้ดังนี้
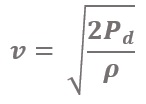
โดยที่
![]() คือ ความเร็วลม (ในหน่วย m/s)
คือ ความเร็วลม (ในหน่วย m/s)
![]() คือ ความดันไดนามิก (ในหน่วย Pa)
คือ ความดันไดนามิก (ในหน่วย Pa)
![]() คือ ความหนาแน่นของไหล (ในหน่วย kg/m3)
คือ ความหนาแน่นของไหล (ในหน่วย kg/m3)
กรณีนี้เราใช้หาความเร็วลมหรืออากาศซึ่งอากาศมีความหนาแน่นโดยประมาณที่ 1.29 kg/m3
การคำนวณหาอัตราการไหล
การคำนวณหาอัตราการไหล (flow rate) นั้นสามารถหาได้จากค่าความเร็วของลมและพื้นที่ของท่อ ดังนี้
อัตราการไหล (m3/s) = ความเร็วแก๊ส (m/s) x พื้นที่หน้าตัดของท่อ (m2)
จากสูตรที่กล่าวมาจะเห็นได้ว่า อัตราการไหล (flow rate) นั้น ปัจจัยจะขึ้นอยู่กับ 2 อย่างคือ ความเร็วลมและขนาดของท่อซึ่งสามารถดูเพิ่มเติมได้ที่ ตารางอัตราการไหล
ปัจจัยที่ส่งผลต่อการวัดอัตราการไหล
ปัจจัยที่ส่งผลต่อการวัดความเร็วลมและอัตราการไหลนั้นจะมีอยู่ทั้งหมด 3 เรื่องคือ
- อุณหภูมิของแก๊ส
- ความดันของแก๊ส
- ชนิดของแก๊ส
หากจะให้อธิบายว่าทั้ง 3 สิ่งนี้มีผลโดยตรงอย่างไรกับการวัดความเร็วลมและอัตราการไหลของแก๊สโดย Pitot tube นั้น เราก็ต้องอธิบายถึงพฤติกรรมของแก๊ส
จาก Boyle’s law อธิบายไว้ว่า ถ้าอุณหภูมิและโมลของแก๊สคงที่ ความดันของแก๊สจะแปรผกผันกับปริมาตรของแก๊สนั้นๆ
พูดง่ายๆคือ ถ้าความดันสูงขึ้นปริมาตรของแก๊สจะลดลงและในทางกลับกันเมื่อความดันลดลงปริมาตรของแก๊สจะเพิ่มขึ้นนั่นเอง
ตามสมการ P1V1 = P2V2
โดยที่ P คือความดันของแก๊ส ; V คือ ปริมาตรของแก๊ส
จาก Charles’s law อธิบายไว้ว่า ถ้าความดันและโมลของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผันตรงกับอุณหภูมิของแก๊สนั้นๆ
พูดง่ายๆคือ ถ้าอุณหภูมิสูงขึ้นปริมาตรของแก๊สก็จะมากขึ้นตามไปด้วยและในทางกลับกันเมื่ออุณหภูมิลดลงปริมาตรของแก๊สก็จะลดลงเช่นกัน
ตามสมการ V1/T1 = V2/T2
โดยที่ V คือปริมาตรของแก๊ส ; T คืออุณหภูมิ
จาก Avogadro’s law อธิบายไว้ว่า ถ้าอุณหภูมิและความดันของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผันตรงกับโมลของแก๊สนั้น
พูดง่ายๆคือ ถ้าปริมาตรของแก๊สสูงขึ้นโมลของแก๊สก็จะสูงขึ้นตามไปด้วยและในทางกลับกันเมื่อปริมาตรลดลงโมลของแก๊สก็ลดลงตามเช่นกัน
ตามสมการ V1/n1 = V2/n2
โดยที่ V คือปริมาตรของแก๊ส ; n คือโมลของแก๊ส
จาก Ideal gas law คือการนำ Boyle’s law, Charles’s law และ Avogadro’s law มารวมกันดังนี้
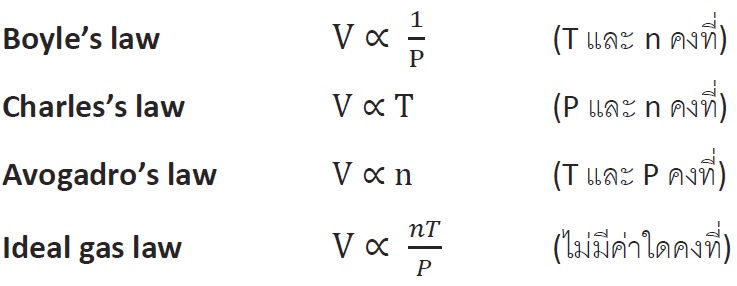
จากทั้งหมดที่กล่าวมาสามารถเขียนเป็นสมการได้คือ PV = nRT-------------------------------------สมการที่ 1
P คือ ความดันของแก๊ส, (Pa)
V คือ ปริมาตรของแก๊ส, (m3)
n คือ จำนวนโมลของแก๊ส, (mol)
R คือ ค่าคงที่ของแก๊ส (8.3145 J•mol-1•K-1)
T คือ อุณหภูมิของแก๊ส, (K)
เพิ่มเติมพิเศษ : แก๊สใดๆ 1 mol จะมีปริมาตร 22.414 L (0.022414 m3) ที่ STP
(ที่ STP คือที่อุณหภูมิ 0 °C หรือ 273.15 K ความดัน 1 atm)
เมื่อเรามองลึกลงไปจำนวนโมลของแก๊สจะมีค่าเท่ากับ n = m/M -----------------------------------สมการที่ 2
n คือ จำนวนโมลของแก๊ส, (mol)
m คือ มวลของแก๊ส, (g)
M คือ มวลโมเลกุลของแก๊ส, (g/mol)
นำสมการที่ 1 และ 2 มารวมกันจะได้เป็น ![]() -----------------------------------------------สมการที่ 3
-----------------------------------------------สมการที่ 3
หากมองดูดีดีแล้วเราจะพบว่าสมการที่ 3 คือความหนาแน่นในหน่วย g/m3 เพื่อให้สอดคล้องกับสมการความเร็วลมแรกเริ่ม
เราจะแปลงหน่วยให้เป็น kg/m3 ดังนี้ ![]() --------------------สมการที่ 4
--------------------สมการที่ 4
เนื่องจากค่าอุณหภูมิ T ในสมการที่ 4 มีหน่วยเป็น องศาเคลวิน (K) ซึ่งยากต่อการเข้าใจ โดยที่ T = Tc + 273.15
T คืออุณหภูมิในหน่วย K
Tc คืออุณหภูมิในหน่วย °C
เราจะแปลงหน่วยให้เป็น องศาเซลเซียส (°C) ดังนี้ ![]() --------สมการที่ 5
--------สมการที่ 5
หากเรายังไม่ลืมว่าค่า R ในสมการที่ 5 คือค่าคงที่ของแก๊สเมื่อเราใส่ค่าเข้าไปเราจะได้สมการความหนาแน่นใหม่ดังต่อไปนี้
![]() --------สมการที่ 6
--------สมการที่ 6
สุดท้ายจะเป็นการนำ สมการที่ 6 ที่ได้จาก Ideal gas law ไปรวมกับ สมการความเร็วลม ที่ได้จาก Bernoulli’s equation
ซึ่งทำให้เราได้สมการการหาความเร็วของไหลโดย Pitot tube ที่สมบูรณ์ดังนี้
 -----สมการสมบูรณ์
-----สมการสมบูรณ์
v คือ ความเร็วของแก๊ส (m/s)
Pd คือ ความดันไดนามิก (Pa)
Tc คือ อุณหภูมิของแก๊ส (°C)
P คือ ความดันสัมบูรณ์ของแก๊ส (Pa)
M คือ มวลโมเลกุลของแก๊ส (g/mol)
เครื่องวัดความเร็วลม และ อัตราการไหล แบบ Pitot tube ที่เราจำหน่าย
เครื่องวัดรุ่น DC410 ยี่ห้อ Wöhler จากเยอรมัน เป็นสุดยอดเครื่องวัดความเร็วลม/อัตราการไหล/ความดัน/ความดันสัมบูรณ์/อุณหภูมิ/ความชื้น ที่สามารถนำค่าอุณหภูมิและความดันสัมบูรณ์ของแก๊สเข้ามาคำนวณหาค่าอัตราการไหลได้อย่างสมบูรณ์แบบและแม่นยำที่สุดแบบที่เครื่องยี่ห้ออื่นไม่มีมาก่อน ทั้งยังสามารถใส่มวลโมเลกุลของแก๊สในกรณีวัดแก๊สชนิดอื่นๆที่ไม่ใช่อากาศ หากลูกค้ามองหาความแม่นยำและความสมบูรณ์แบบในทุกๆด้าน เชื่อว่าเครื่องวัดตัวนี้จะตอบโจทย์ลูกค้าอย่างแน่นอน
เครื่องวัดรุ่น TA400 ยี่ห้อ TROTEC จากเยอรมัน เป็นเครื่องวัดความเร็วลม/อัตราการไหล/ความดัน แบบราคาประหยัดที่มีความสามารถพื้นฐานในการวัดอย่างครบถ้วนสำหรับการวัดความเร็วลมและอัตราการไหลของอากาศเหมาะสำหรับผู้ใช้ที่ต้องการคุณภาพแบบเยอรมันในราคาที่ย่อมเยา
การหามวลโมเลกุลของแก๊สผสม
มวลโมเลกุลของแก๊สคือหนึ่งในปัจจัยหลักอย่างหนึ่งที่มีผลต่อการวัดความเร็วและอัตราการไหลของแก๊ส มันคงไม่ใช่ปัญหาอะไรหากแก๊สที่วัดนั้นเป็นแก๊สชนิดเดียว ซึ่งทำให้เราสามารถทราบมวลโมเลกุลของแก๊สอย่างง่ายดาย แต่ถ้าเป็นแก๊สผสมละ เราจะหามวลโมเลกุลอย่างไร นี่คือคำถามที่หลายคนสงสัย ครั้งนี้เราจะยกตัวอย่างการหามวลโมเลกุลของแก๊สผสมสุดคลาสสิกนั่นคือ...อากาศ
อากาศประกอบไปด้วยแก๊สชนิดหลักๆอยู่จำนวน 3 ชนิด นั่นคือ
- Nitrogen (N2) ≈ 78%
- Oxygen (O2) ≈ 21%
- Argon (Ar) ≈ 1%
ขั้นที่ 1 หามวลโมเลกุลตามสูตรทางเคมี
มวลโมเลกุลของ Nitrogen (N2) = 14.00674 x 2 = 28.01348 g/mol
มวลโมเลกุลของ Oxygen (O2) = 15.9994 x 2 = 31.9988 g/mol
มวลโมเลกุลของ Argon (Ar) = 39.948 g/mol
ขั้นที่ 2 คิดตามสัดส่วนของแก๊สจากปริมาตรทั้งหมด
มวลโมเลกุลของอากาศเท่ากับ { (28.01348x78)+(31.9988x21)+(39.948x1) }/ 100 = 28.9697424 g/mol
ดังนั้น มวลโมเลกุลของอากาศมีค่าประมาณ 28.97 g/mol

